OBJETIVOS
*Relacionar los cambios de temperatura con la reversibilidad característica de los equilibrios químicos.
*Relacionar los cambios de temperatura con la reversibilidad característica de los equilibrios químicos.
*Observar los desplazamientos de equilibrio relacionados con el cambio de concentración en reactantes y productos.
FUNDAMENTO
El equilibrio químico se aplica al estudio de las reacciones reversibles, en el curso de las cuales existe la posibilidad de que los átomos de las moléculas resultantes de la reacción se reagrupen para formar las moléculas de los reaccionantes.
Los fenómenos en los dos sentidos, formación de productos y formación de reacciones, suceden en forma continua hasta que se alcanza un estado de equilibrio dinámico, en el cual las reacciones directa e inversa tienen lugar con igual velocidad, de tal manera que a nivel macroscópico no hay evidencia de cambio.
A Henry Louis Le Chatelier (1850 – 1936), químico francés, se le atribuye un enunciado cualitativo útil, que considera la influencia que tienen diversos factores sobre la condición de equilibrio.
El principio de Chatelier en esencia expresa “Si se somete un sistema en equilibrio a determinada perturbación (tal como un cambio de temperatura, presión o concentración), se produce una reacción que desplaza el equilibrio en tal sentido que tiende a anular dicha perturbación. Este principio es más claro de enunciarse y es extremadamente útil para entender los efectos de las variaciones de temperatura, presión o concentración de los sistemas en equilibrio.
Las reacciones que queremos considerar, son aquellas en las cuales se ha establecido un equilibrio entre dos reacciones opuestas.
Los factores que afectan a una reacción son:
Concentración
Si varía la concentración de un sistema que en principio esté en equilibrio químico, en ese sistema variarán también las concentraciones de sus componentes de manera que se contrarreste la primera variación. Con respecto a su representación mediante una ecuación estequimétrica, diremos que el equilibrio se desplazará a un lado o al otro de esa ecuación (en dirección a un miembro o al otro).
Por ejemplo, si aumenta la concentración de yoduro de hidrógeno en la reacción representada así:
- H2 + I2 ←→ 2 HI
ocurrirá que habrá más yoduro de hidrógeno que se transforme en moléculas de hidrógeno y de yodo que lo contrario, y, según esa representación, diremos que esa reacción se desplazará a la izquierda..
Cambio de temperatura
Si aumenta la temperatura en un sistema que en principio esté en equilibrio, ese sistema se reorganizará de manera que se absorba el exceso de calor; y, en la representación estequiométrica, diremos también que la reacción se desplazará en un sentido o en el otro.
Hay dos tipos de variación con la temperatura:
- Reacción exotérmica: aquella reacción que libera o desprende calor.
Por ejemplo:
- aA + bB ←→ cC + dD + Calor
En este caso se puede apreciar que si aumenta la temperatura habrá un desplazamiento del equilibrio hacia los reactivos (←); y, si disminuye la temperatura, habrá un desplazamiento hacia los productos (→).
- Reacción endotérmica: aquella que absorbe calor.
Por ejemplo:
- aA + bB + Calor ←→ cC + dD
En este otro caso, se aprecia que la disminución de temperatura afecta a los reactivos, de manera que se produce un desplazamiento del equilibrio hacia éstos (←). En cambio, si aumenta la temperatura, el equilibrio se desplazará hacia los productos (→).
Cambio de Presión
Si se eleva la presión de un sistema de gases en equilibrio, la reacción se desplaza en la dirección en la que desaparezcan moles de gas, a fin de minimizar la elevación de presión. Por el contrario, si disminuye la presión, la reacción se desplazará en el sentido en que aumenten las moles totales de gas lo que ayudará a que la presión no se reduzca. Es importante hacer notar que, a bajas temperaturas, la reacción requiere más tiempo, ya que esas bajas temperaturas reducen la movilidad de las partículas involucradas.
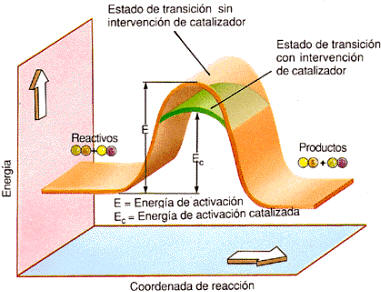
En el laboratorio, para contrarrestar ese efecto se emplea un catalizador que acelere la reacción.